ESMO 2014: CÂNCER DE PULMÃO
- abrasivo
- 19 de janeiro de 2016
Autoras: Clarissa Baldotto e Tatiane Montella
O Congresso da Sociedade Européia de Oncologia Clínica aconteceu na cidade de Madri, Espanha, entre os dias 26 e 30 de setembro de 2014. Trata-se de um dos congressos mais importantes da área, reunindo profissionais do mundo todo. É característica deste encontro, não só a apresentação de novos dados científicos, mas principalmente aulas de revisão, educativas, visando a consolidação e implementação de resultados apresentados e publicados previamente.
Em câncer de pulmão foram apresentados alguns estudos importantes, muitos deles sobre terapia alvo e imunoterapia, que talvez tenha sido o assunto mais discutido durante todo o evento. Na sessão presidencial, que costuma ser uma seleção dos mais relevantes trabalhos, dois deles eram sobre câncer de pulmão não pequenas células (CPNPC).
O estudo fase 3 IMPRESS, apresentado pelo Dr. Tony Mok, respondeu a uma importante pergunta: qual a melhor estratégia após falha ao inibidor de tirosina quinase (TKI), em pacientes com mutação de EGFR? Ao todo 265 pacientes, com CPNPC avançado, histologia não-escamosa, com mutações de EGFR de sensibilidade e falha a gefitinibe, foram randomizados para receber a combinação de gefitinibe/quimioterapia (QT) ou placebo/quimioterapia. O objetivo principal era a diferença entre sobrevida livre de progressão (SLP). O estudo foi negativo, sem diferença em SLP (HR= 0,86; p=0,273). A SLP mediana foi de 5,4 meses em ambos os braços (Figura 1). O interessante é que, embora o dado seja imaturo, a sobrevida global foi pior no braço que seguiu o gefitinibe (HR=1,62; p=0,029). A conclusão foi que nestes pacientes o uso de TKI deve ser interrompido no momento da progressão, e iniciada a QT. Na discussão foram abordados os diversos mecanismos de resistência aos TKIs e o fato de que o resultado deste estudo não impede que pacientes sejam retratados com o TKI após falha a QT (Ann Oncol 2014; 25 Suppl
4 Abst LBA2_PR).
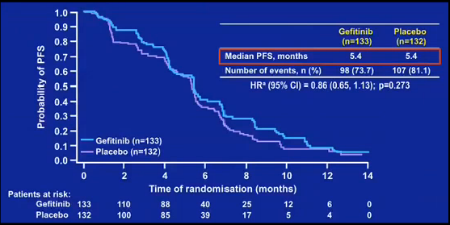
Figura 1. Sobrevida Livre de Progressão de Gefitinibe comparado com placebo no estudo IMPRESS
Ainda na Sessão Presidencial, o estudo MAGRIT avaliou a eficácia da imunoterapia adjuvante em CPNPC, com o uso do antígeno tumor-específico MAGE A-3. Este se encontra expresso em várias células tumorais, mas não em tecidos normais. Em CPNPC costuma ser encontrado em 35% dos tumores em estadios iniciais. Foi um estudo randomizado, duplo-cego, controlado com placebo, com o objetivo principal de avaliar diferenças na Sobrevida Livre de Doença (SLD) entre os braços (MAGE A-3 versus placebo). Somente pacientes de estadio IB a IIIA, submetidos a ressecção cirúrgica R0, e com positividade para o antígeno foram incluídos. Ao todo foram testados 13.849 pacientes e randomizados 2.272 pacientes. Todos poderiam ter recebido quimioterapia adjuvante e depois foram randomizados para receber 13 injeções intramusculares do agente investigacional (período de 27 meses de tratamento).
No total, 52% dos pacientes receberam QT adjuvante, e 47% dos pacientes foram estadiados como IB. O seguimento mediano foi de 38,8 meses. A SLD não foi diferente entre os grupos, sendo de 60,5 meses versus 57,9 meses para MAGE-A3 e placebo, respectivamente (HR=1,024; p=0,7379). A diferença de SLD também não foi significativa no grupo de pacientes que não recebeu QT adjuvante (58 m versus 56,9 m; HR=0,970, p=0,7572). Como conclusão os autores reforçaram que este foi o maior estudo de imunoterapia adjuvante em CPNPC. Mas infelizmente, apesar do racional promissor, e dos eventos adversos brandos, trata-se de outro importante estudo negativo. Na discussão foram abordadas as potenciais vantagens das vacinas no contexto da doença inicial. Também foram discutidas prováveis causas para a ausência de benefício encontrada, como o fato de esta ser uma vacina monovalente e alguns mecanismos de resistência (alterações epigenéticas e escape imunológico). (Ann Oncol 2014; 25 Suppl 4: iv409).
O estudo fase 3 Lux-Lung 8 foi tema de uma apresentação oral. Nele foram incluídos apenas pacientes portadores de carcinoma epidermóide (CEC) de pulmão, com doença avançada, e falha a quimioterapia de 1a linha. A randomização era entre erlotinibe e afatinibe. O CEC de pulmão corresponde hoje a cerca de 30% dos casos de CPNPC, e o afatinibe é um pan-inibidor irreversível de EGFR (EGFR, HER2 e HER4), aprovado em alguns países, para o tratamento de pacientes com adenocarcinoma e mutação de EGFR. O objetivo principal era avaliar diferenças em SLP, mas o estudo tinha poder suficiente para avaliar também diferenças de SG. Foram recrutados 795 pacientes entre março de 2012 e janeiro de 2014. A SLP mediana foi significativamente maior no braço experimental do afatinibe (2,4 meses vs 1,9 meses; p=0,0427) (Figura 2). A taxa de resposta global foi igual, mas a taxa de controle de doença também foi maior com afatinibe (45,7% vs 36,8%; p=0,020). Os dados de SG ainda são imaturos.
Os eventos adversos foram os eventos típicos desta classe de drogas (rash cutâneo, diarréia). Os autores concluíram que este é o maior estudo de fase 3 positivo, com o uso de droga-alvo para esta população. Ressaltaram o perfil conhecido e esperado de eventos adversos e a imaturidade dos dados de SG (Ann Oncol 2014; 25 Suppl 4: iv426). Na discussão foi lembrado que embora seja um estudo positivo, trata-se de um benefício marginal em comparação com o erlotinibe, e que há um relativo aumento de eventos adversos, ainda que leves.
Esta é uma população de pacientes que na maioria das vezes é tratada preferencialmente com quimioterapia, carecendo de terapia alvo, mas há dados emergentes promissores com novas drogas, principalmente no campo da imunoterapia.

Figura 2. Sobrevida Livre de Progressão nos braços de afatinibe e erlotinibe no estudo Lux-Lung 8
Falando um pouco de imunoterapia, inúmeros trabalhos, com os mais variados tumores e diferentes desenhos foram apresentados durante o Congresso da ESMO 2014, principalmente com os anticorpos anti-PD-1/anti-PD-L1, inibidores de checkpoint. Até o momento os resultados não reformulam as condutas terapêuticas, mas levantam hipóteses e geram estudos em fases mais avançadas. Três estudos de fase 1, com drogas anti-PD1 diferentes foram apresentados. Em dois deles, os resultados sugerem que a expressão de PD-L1 parece ter relação com a taxa de resposta às drogas avaliadas, introduzindo o conceito de biomarcadores para essa terapia.
Na sessão oral, foram revelados os resultados do estudo que avaliou a atividade anti-tumoral do pembrolizumab (Pembro; MK-3475) e a correlação com a expressão de PD-L1 em pacientes com CPNPC e doença avançada. No total, 282 pacientes com CPNPC virgens de tratamento, ou previamente tratados, da coorte do estudo de Fase 1b em curso (KEYNOTE-001), foram analisados. A expressão tumoral de PD-L1 foi determinada prospectivamente e três diferentes doses de pembrolizumab foram oferecidas: 2mg/Kg a cada 3 semanas, 10mg/kg a cada 3 semanas ou 10mg/kg a cada 2 semanas até progressão, morte ou toxicidade inaceitável. Os dados apresentados para 262 pacientes (mediana de seguimento de 5,4 meses) demonstraram a atividade antitumoral (taxa de resposta global) com pembrolizumab, em pacientes com CPNPC avançado nunca tratados e previamente tratados de 26% e 20%, respectivamente, em todas as doses e posologia, conforme avaliados centralmente de acordo com critérios RECIST v1.1 e critério de resposta imune-relacionada.
A análise por dose (2 mg/kg cada três semanas, 10 mg/kg cada três semanas 10 mg/kg a cada duas semanas) demonstrou taxa de resposta comparável para os três esquemas posológicos (33%, 21% e 21% respectivamente) e não houve diferença de resposta em relação a histologia. Pacientes que apresentavam forte expressão de PD-L1 (>50%) e receberam a droga experimental, aparentemente apresentaram maior beneficio em relação a taxa de resposta global do que os pacientes com expressão fraca ou negativa de PD-L1 (39% vs 16%). Eventos adversos grau 3-5 ocorreram em 9% dos pacientes, sendo o mais comum pneumonite (Ann Oncol 2014; 25 Suppl 4:LBA43).
O outro estudo de fase 1 também apresentava como objetivo a avaliação de biomarcadores associados à atividade clínica de uma droga anti-PD-L1, neste caso o MPDL3280A. Para isso, 53 pacientes com CPNPC foram incluídos e suas amostras tumorais avaliadas por imunohistoquímica e através de imunochip (mensurando 90 genes imuno-relacionados- Genentech). A taxa de resposta global foi associada à expressão de PD-L1 em células imunes infiltradas no tumor (p=0,02) : IHC 3: ORR 83% (5/6), IHC 2: 14% (1/7), IHC 1: 15% (2/13), IHC 0: 20% (4/20). Porém, não houve associação de taxa de resposta global com a expressão de PD-L1 em células tumorais (Ann Oncol 2014; 25 Suppl 4: iv465).
O terceiro trabalho, também de fase 1, teve como objetivo avaliar a atividade clínica e segurança do MEDI4736, outra droga anti-PD-L1. O MEDI4736 foi administrado intravenoso em 114 pacientes com CPNPC, usando dose escalonada padrão (3+3) e dose de expansão, típico de um estudo fase 1. De 101 pacientes tratados com 10mg/kg a cada 2 semanas (mediana de 3 doses recebidas), 20% apresentaram eventos adversos relacionados ao tratamento, sendo o mais frequente dispneia (16%), fadiga (15%) e náusea (15%). Nenhum paciente interrompeu o tratamento por eventos relacionados à droga. A maioria dos pacientes já havia recebido mais de duas linhas de tratamento prévio. O benefício do tratamento foi considerado durável e 72/114 pacientes permaneciam no estudo (incluindo 4 pacientes com mais de 52 semanas).
Dados de correlação com expressão de PD-L1, mutação, tabagismo e linhas de tratamento estão em andamento (Ann Oncol 2014; 25 Suppl 4: iv466). Outra questão muito estudada e também abordada na ESMO 2014, é a opção de tratamento pós-resistência aos TKIs. Com o intuito de avaliar a atividade antitumoral do alectinib em pacientes ALK positivos, previamente tratados com crizotinib, um estudo japonês com 35 pacientes foi desenvolvido.
Esse estudo se propôs inicialmente a avaliar a bioequivalência do alectinib 300 mg (2 vezes ao dia) com cápsulas de 20/40mg vs 150mg. A mediana de seguimento foi de 141 dias e até o fechamento dos dados, 21 pacientes continuavam o tratamento com alectinib sem progressão de doença. A taxa de resposta foi de 58,3 % e a taxa de controle de doença de 83.3%. A maior parte dos pacientes que apresentavam metástase no sistema nervoso central (SNC) (13/19) permaneciam no estudo sem progressão de doença. Não houve interrupção de tratamento relacionada a toxicidade. Desordens gastrointestinais e visuais, características do tratamento com crizotinib, não foram tão frequentes com alectinib. A conclusão é que há boa tolerância ao alectinib e resposta promissora, inclusive em pacientes com metástase no SNC. (Ann Oncol 2014; 25 Suppl 4: iv427).
Ainda no campo da terapia alvo, dois estudos avaliaram estratégias para subpopulações de CPNPC, obtidas a partir de seleção molecular. No estudo fase 2 BRF113928, 84 pacientes portadores de CPNPC avançado e a mutação V600E de BRAF foram incluídos, e receberam dabrafenib 150 mg 2 vezes ao dia. O objetivo principal avaliado foi taxa de resposta global (TRG) pelos critérios de RECIST 1.1.
A duração mediana de tratamento foi de 4,3 meses. A TRG para os 78 pacientes com duas ou mais linhas prévias de tratamento foi de 32%, e a mediana de duração de resposta foi de 11,8 meses. De 6 pacientes que receberam a droga como 1a linha de tratamento, a metade obteve resposta parcial. Os eventos adversos mais comuns foram febre (36%), astenia (30%), hiperceratose (30%), anorexia (29%) e náuseas (27%). A incidência reportada de CEC de pele foi de 18%. Na discussão foi lembrada a incidência de 1,5% da mutação V600E de BRAF em pacientes com CPNPC avançado, e o fato da mesma não coexistir com outras mutações mais comuns (EGFR, KRAS, ALK). O dabrafenib, pelo menos nesta fase inicial, mostrou atividade clínica nesta subpopulação (Ann Oncol 2014; 25 Suppl 4: LBA38_PR).
O segundo estudo, também de fase 2, avaliou o uso de neratinib, com ou sem temsirolimus, para o tratamento de pacientes com CPNPC, portadores de mutações somáticas de HER2. Estas mutações ocorrem em cerca de 2-4% dos pacientes com CPNPC avançado. Os pacientes foram randomizados para receber neratinib isolado ou combinado a tensirolimus, até progressão de doença ou toxicidade. O cruzamento era permitido. O objetivo principal era avaliar TRG. Em uma primeira etapa, foram randomizados 27 pacientes. A TRG foi de 21% no braço da combinação, versus 0% no braço de neratinib isolado. Os eventos adversos de graus ¾ mais comuns foram dispneia, diarreia, vômitos e nauseas. A discussão, comum aos dois trabalhos, sugeriu que a combinação de neratinib e tensirolimus merece ser melhor avaliada em estudos posteriors. Também foi questionada a necessidade de estudos de fase 3 em populações tão raras e selecionadas (Ann Oncol 2014; 25 Suppl 4: LBA39_PR).
Por Clarissa Baldotto e Tatiane Montella

